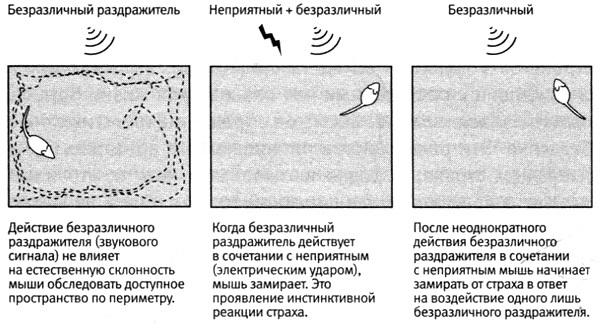
Начало моих исследований приобретенного страха у мышей было в некотором роде естественным продолжением экспериментов с аплизией. В случае с аплизией животное, у которого вырабатывается классический условный рефлекс, учится ассоциировать два раздражителя: безразличный (легкое прикосновение к сифону) и другой, достаточно сильный, чтобы вызывать инстинктивный страх (удар током в заднюю часть тела). У мышей удар током по ногам, подобно удару в заднюю часть тела у аплизии, вызывает инстинктивные реакции страха: отдергивание, прижимание к субстрату и замирание. Воздействие безразличного раздражителя, такого как простой звуковой сигнал, не вызывает таких реакций. Однако после неоднократного воздействия звукового сигнала в сочетании с ударом тока мышь общается ассоциировать эти два раздражителя. Она запоминает, что звуковой сигнал предшествует удару томом. В итоге звук сам по себе начинает вызывать у нее реакцию страха (рис. 25–2).
25–2. Формирование у мышей приобретенного страха.
Хотя система нейронных цепей, лежащая в основе приобретенного страха у мышей, намного сложнее, чем соответствующая система у аплизии, о ее устройстве уже кое-что известно благодаря исследованиям Джозефа Леду из Нью-Йоркского университета и Майла Дэвиса, работающего сейчас в Университете Эмори. Они установили, что и у грызунов, и у людей в механизмах как врожденного, так и приобретенного страха задействована определенная нейронная цепь, связанная с миндалевидным телом. Кроме того, они выяснили принципиальную схему поступления информации о безусловных и условных раздражителях в миндалевидное тело и запускания миндалевидным телом сигналов, вызывающих реакции страха.
Когда звуковой сигнал сопровождается ударом тока по ногам, информация о звуке и ударе вначале передается по двум разным путям. Звук (условный раздражитель) вызывает активацию сенсорных нейронов так называемой улитки — отдела внутреннего уха, отвечающего за восприятие звуков. Аксоны этих нейронов ведут к группе нейронов таламуса, связанных со слухом. Нейроны образуют два проводящих пути: прямой, ведущий непосредственно в боковое ядро миндалевидного тела, вообще не заходя в кору, и непрямой, ведущий сначала в слуховую кору, а затем в боковое ядро миндалевидного тела (рис. 25–3). Эти два пути, передающие информацию о звуке, заканчиваются синаптическими связями с пирамидальными нейронами, представляющими главный тип клеток бокового ядра.

25–3. Нейронные проводящие пути, обеспечивающие реакцию приобретенного страха.
Болевое воздействие удара тока (безусловного раздражителя) вызывает активацию проводящего пути, ведущего к другой группе нейронов таламуса, осуществляющей обработку болевых сигналов. Эти нейроны тоже образуют как прямой, так и непрямой пути, ведущие к пирамидальным клеткам бокового ядра. Непрямой путь в данном случае проходит через соматосенсорную кору.
Открытие двух отдельных путей (проходящего через кору и не заходящего в нее) непосредственно доказывало, что бессознательная оценка пугающего раздражителя предшествует сознательной — в соответствии с предсказаниями теории Джеймса — Ланге. Вызывая активацию более быстрого прямого проводящего пути, не заходящего в кору пугающий раздражитель может заставить наше сердце колотиться, а ладони — потеть еще до того, как активация более медленного пути позволит нам осознать, например, что где-то рядом раздался выстрел.
Боковое ядро не только служит местом встречи для информации об условном (звуке) и безусловном (ударе током) раздражителях, но и вызывает мобилизацию адаптивных реакций, осуществляемую через связи нейронов этого ядра с гипоталамусом и поясной извилиной коры. Гипоталамус играет ключевую роль в физиологических проявлениях страха, запуская реакцию «борьбы или бегства» (повышенная частота сердцебиения, потоотделение, сухость во рту и напряжение мышц). Работа поясной извилины связана с сознательной оценкой страха.
Так каков же механизм работы приобретенного страха у мышей? Включает ли он изменения синаптической силы в проводящих путях под действием условного раздражителя, как это происходит у аплизии? Чтобы найти ответ, ряд ученых, в том числе я и мои коллеги, работали со срезами миндалевидного тела мышей. Результаты предшествующих исследований показали, что стимуляция как прямого, так и непрямого проводящего пути с частотой, близкой к той, что использовали Блисс и Лемо в своих экспериментах с гиппокампом, приводит к усилению этих путей, представляющему собой разновидность долговременной потенциации. Мы исследовали эту разновидность биохимическими методами и установили: хотя она немного отличается от той, что происходит в гиппокампе, зато почти ничем не отличается от долговременного усиления синаптических связей, задействованного у аплизии в сенсибилизации и выработке классического условного рефлекса (двух форм приобретенного страха). В обоих случаях работает молекулярный сигнальный путь, в котором участвуют циклический АМФ, протеинкиназа А и регуляторный белок CREB. Эти открытия в очередной раз показывали, что долговременное усиление синапсов у аплизии и различные формы долговременной потенциации у млекопитающих входят в одно семейство молекулярных процессов, позволяющих надолго усиливать синаптические связи.
В 2002 году моим сотрудником стал Майкл Роган, ранее работавший у Джозефа Леду, и мы с ним перешли от изучения срезов мозга мышей к экспериментам с интактными животными. Мы исследовали реакцию нейронов миндалевидного тела мышей на звуковой сигнал и обнаружили то же, что Роган и Леду выявили ранее про крыс, а именно: приобретенный страх усиливает эту реакцию (рис. 25–4). Такое явление напоминало долговременное усиление синаптических связей, которое мы наблюдали в срезах миндалевидного тела. Тогда сотрудничавший с нами Вадим Большаков из Гарварда предположил, что если синапсы в миндалевидном теле интактной мыши усилены приобретенным страхом, то электрическая стимуляция синапсов в срезах миндалевидного тела той же мыши не будет приводить к дальнейшему существенному усилению этих синапсов. Так и оказалось. То есть изменения, происходящие в миндалевидном теле живых мышей в результате обучения, похожим образом проявляются в тех же точках, что и изменения, вызываемые электрической стимуляцией срезов миндалевидного тела.

25–4. Изменения в работе нейронных путей, связанных со страхом, происходящие в результате обучения.
Затем мы воспользовались хорошо отработанным методом поведенческого тестирования на приобретенный страх. Мы помещали мышь в большой открытый ярко освещенный ящик. Мыши — ночные животные, поэтому они боятся яркого света и в норме будут носиться по дну ящика вдоль стенок, лишь изредка забегая в его середину. Такая форма защитного поведения представляет собой компромисс между потребностью животного в обследовании окружающей среды и в избегании хищников. Когда мы включали звуковой сигнал, мышь продолжала бегать вдоль стенок ящика как ни в чем не бывало. Но после того как мы неоднократно сопровождали звуковой сигнал ударом тока, мышь обучалась ассоциировать эти два раздражителя. Теперь, услышав звук, она переставала бегать вдоль стенок, изредка забегая в середину, и сидела, прижавшись ко дну, в одном из углов, обычно в позе замирания (рис. 25–2).
Разобравшись в особенностях анатомии и физиологии приобретенного страха, мы почувствовали, что можем изучить молекулярные основы этого явления. Вместе с постдоком Глебом Шумяцким я занялся поиском генов, которые экспрессировались бы только в боковом ядре миндалевидного тела — уже исследованном нами участке. Мы выяснили, что в пирамидальных клетках экспрессируется ген, который кодирует определенный нейромедиатор — так называемый гастрин-высвобождающий пептид. Пирамидальные клетки используют этот пептид в качестве возбуждающего нейромедиатора в дополнение к глутамату и совместно с ним, выделяя эти медиаторы из пресинаптических окончаний, ведущих к клеткам-мишеням бокового ядра. Затем мы обнаружили, что клетки-мишени относятся к особой популяции тормозных интернейронов, в мембране которых содержатся рецепторы к гастрин-высвобождающему пептиду. Как и все тормозные интернейроны бокового ядра, клетки-мишени выделяют нейромедиатор ГАМК. Клетки-мишени могут передавать сигналы обратно на пирамидальные клетки и, активируясь, выделяют в синаптические щели ГАМК, тем самым тормозя работу пирамидальных клеток.
